摘要:2021年以來,MRD漸成風口,國內大小企業爭相入局。
2021年以來,MRD漸成風口,國內大小企業爭相入局。
作為腫瘤預后管理的剛需產品,市場對MRD檢測抱有很高的期待,期待著它能否先早篩一步,成為基因檢測玩家的增長引擎。
賽道愈加火熱的同時,投資者的辨別難度卻越來越大:從技術到出海,MRD大小玩家都在強調自己是賽道領先者。
一個不可忽略的現實是,MRD檢測領域火爆歸火爆,現在談“領先”還為時尚早。基于NGS的血液瘤MRD檢測產品,才剛剛起步;實體瘤MRD檢測產品,更是有待攻克。
不過,一切事物的發展,總是有跡可循。如何才能辨別誰是真正的實力玩家,判斷MRD市場的中局乃至終局?基因檢測公司的合作伙伴陣容,為我們提供了一個不錯的觀察窗口。
/ 01 /評價MRD玩家實力的一個維度:合作伙伴的數量和質量
當前,雖然各家公司都表示自己技術實力突出,但由于MRD產品還處于研發早期階段,性能標準并不統一。因此,技術優劣、性能高下,很難簡單做出判斷。
而基因檢測公司MRD產品合作伙伴的陣容,則是衡量MRD玩家實力的一個重要維度。原因在于,隨著NGS測序技術帶來的改變,血液瘤MRD檢測產品在臨床試驗中的應用已經相當廣泛。
當前,藥企血液瘤藥物的臨床試驗中,往往會涉及MRD檢測。比如,天境生物的核心產品CD47單抗TJ011133,在國內開展的聯合阿扎胞苷治療急性髓系白血病,或骨髓增生異常綜合征的I/IIa期臨床研究中,便明確表示探索骨髓MRD與預后的相關性。

![]() 在藥企需求已經爆發的當下,必然已經有基因檢測玩家,成為藥企的上游供應商。那么,作為MRD檢測產品消費者的藥企,最核心的需求是什么?
在藥企需求已經爆發的當下,必然已經有基因檢測玩家,成為藥企的上游供應商。那么,作為MRD檢測產品消費者的藥企,最核心的需求是什么?
答案是:優異的檢測性能、良好的實驗室資質。前者直接影響臨床試驗結果;后者一方面決定了臨床試驗是否能滿足境內、境外合規性要求,另一方面反映了實驗室的綜合管理能力和質量水平,是檢測性能穩定性、檢測數據準確性的底層保障。
國際上含金量較高的醫學實驗室認可體系包括CAP、CLIA、ISO15189認證,目前中國國內已經有一小部分NGS醫學檢驗實驗室同時具備了此三項認證。
與此同時,為保障臨床試驗順利開展,在合作開展初期藥企通常會針對MRD檢測合作伙伴的質量管理體系進行嚴格稽查。由此,通過公司已達成合作的藥企數量,我們可以一窺MRD賽道玩家的綜合實力。
除了數量,基因檢測公司MRD產品合作伙伴的質量也很重要。畢竟,合作伙伴是跨國頂尖藥企,還是國內不知名的初創型創新藥企,含金量是有差別的。數量與質量并重,無疑是最理想的狀態。
/ 02 /科技部官網告訴你:誰才是實力玩家
一個現實的問題是,如何找到基因檢測玩家MRD產品合作伙伴的情況?答案是,科技部政務服務平臺。
中國人類遺傳資源具有重要的戰略意義,因此涉及到基因檢測相關的業務,都需要審批或者備案。只有審批通過或者備案完成,才能進行臨床試驗。
而無論是審批還是備案,兩者都有公示環節,在科技部網站都可以查詢到結果。通過科技部網站,便能找到相關數據,為研究提供一定的支撐。
之所以說是支撐,是因為在研究過程中還要借助海內外臨床試驗公示平臺,進行驗證。因為科技部服務平臺公布的數據,僅有該臨床試驗的第三方實驗室名單,沒有具體的檢測項目,無論伴隨診斷還是MRD檢測,都會歸在其中。如下圖所示,單看這一臨床審批,并不清楚檢測項目的具體類別。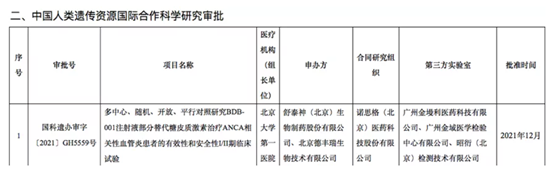
臨床試驗公示平臺則相反:往往只公布臨床檢測項目內容,而不公布合作伙伴。兩個平臺的數據相結合,可以起到“閉環”驗證的作用。
比如前文提到的天境生物臨床試驗。可以看到,金域醫學以第三方實驗室合作伙伴的身份出現在在科技部的審批結果名單中,結合臨床試驗所需的檢測項目,大致可以判斷金域醫學是為天境生物提供MRD檢測服務。
不過,要想找到更全的數據,國內臨床公示平臺遠遠不夠。因為個別臨床項目,即便有MRD檢測產品也未必會披露。
不少臨床試驗由海外巨頭發起,這些海外巨頭在國內披露的臨床信息,或許不如海外公示平臺詳細。如果漏掉這一環,會導致評價維度的不全面。
比如,根據科技部11月份的審批公告,可以看到,輝瑞開展的BCMA雙抗三重難治性骨髓瘤臨床試驗中,第三方實驗室中包括泛生子。
但由于國內臨床信息披露有限,無法判斷泛生子在該臨床中的作用,究竟是基因檢測還是MRD檢測。

這時候,如果能夠結合海外臨床信息,便可以大致判斷,泛生子在該臨床中起到的作用是MRD檢測。
輝瑞在clinicaltrials.gov披露的同適應癥臨床試驗信息中,披露了更詳細的次要終點信息,包括“最小殘留疾病陰性率”,明確表示需要每12個月評估一次。

考慮到這兩個臨床進展差異不大,實驗設計也基本相同,所以泛生子在上述臨床中的作用也就不言而喻了。
這個例子說明,盡管略有繁瑣,但要想判斷MRD玩家的實力,結合海外信息必不可少。上文提及,判斷實力玩家的維度,除了合作伙伴數量,還有質量。
仍以泛生子為例,如果沒有結合海外信息,根據科技部和國內臨床平臺披露的信息,得出的結果是,其合作方僅是國內的康方生物、艾欣達偉和明聚生物等玩家。雖然數量不少,但缺少了海外巨頭,“質量”維度難免要打折。
對任何一個基因檢測玩家來說,能與輝瑞、強生等海外大藥廠開展合作,都是其實力的有力佐證。

反過來,對于一些宣稱自身技術過硬的基因檢測公司,如果通過上述各平臺檢索下來,并不能看到它們的合作伙伴信息,又或者數量不多、質量不高,那就要斟酌一番了。
顯然,要想發現真正的實力玩家,需要一雙慧眼。
/ 03 /從當下預見未來:誰是最終王者?
通過科技部網站發布的信息,我們能夠判斷誰在血液瘤MRD領域更受藥企歡迎不假,借此猜想終局也不難理解。
從目前來看,血液瘤MRD產品會率先發展。而受到藥企歡迎的產品,某種程度上也說明其產品具有性能等綜合優勢。因此,這些產品在血液瘤MRD檢測領域脫穎而出,不會讓人感到意外。
但這與行業終局,似乎關聯不大。畢竟,整個MRD檢測市場,前景最大的是實體瘤MRD檢測。因為超過90%的腫瘤患者都是實體瘤。
眼下,各家的實體瘤MRD產品基本都還處于更早期階段。實體瘤MRD產品的檢測原理和難度,與血液瘤完全不同。所以,即便某個基因檢測玩家的血液瘤MRD產品實力突出,但這與實體瘤領域,并沒有必然聯系。
聽上去沒錯,但也不完全對。關于這一點,我們需要先明白,實體瘤MRD檢測產品的核心競爭力是什么?
答案不難回答:性能突出、便宜好用,當然還有一點,研發進度領先。所有醫療產品的競爭力基本都是這三點,關鍵在于如何做到。
實體瘤MRD檢測產品要做到這三點難度極大,尤其離不開一個關鍵的角色:數據。
先來看性能。任何一款基因檢測產品性能的提升,都需要大量的樣本數據來驗證。對于實體瘤MRD檢測來說更是如此。因為實體瘤治療后能夠釋放到血液中的標志物含量非常有限,這就要求檢測產品十分靈敏,同時還必須避免過于靈敏把噪音認成信號導致假陽性。只有在大量真實臨床數據的支持下,檢測算法找到的平衡點才更接近最優解。
再來看研發進度。MRD檢測產品,最終需要長期跟蹤,明確知道每一個樣本患者是否復發,這是一個長周期的過程。即,如果想要快速推進實體瘤MRD檢測產品的研發,不僅對一個時間切片上的橫向數據有要求,更對長時間尺度的數據積累有明確要求。
最后是成本。實體瘤MRD檢測產品成本的下降,更加離不開數據。
實體瘤MRD檢測產品研發的難點之一在于,實體瘤突變靶點較多,很難有一款產品可以做到全面篩選。當前的MRD檢測產品,主要走高端定制化路線:首先通過WES全外顯子檢測,去確定腫瘤患者基因突變的靶點,然后再設計相應的產品去持續跟蹤。定制化的產品,成本必然不會太低。
而MRD檢測產品要想實現價格“親民”,離不開產品標準化。標準化的關鍵則在于,找到適應癥患者突變位點的共性,盡量排除患者間異質性影響,在可控的成本、有限的檢測位點下對患者做到盡量全面的覆蓋。實體瘤MRD產品的標準化是否能做好,很大程度上受制于是否有多維度、長時間、大規模的臨床數據積累。
綜上不難看出,實體瘤MRD檢測產品護城河的構建,都指向了“數據”這一關鍵要素,而這正是藥企的核心資產。因此,基因檢測玩家要想攻克實體瘤,離不開藥企的幫助。從近期公開的泛生子與阿斯利康實體瘤MRD合作來看,其合作重點之一便是利用檢測公司的技術與藥企的臨床樣本積累,達到1+1>2的效果。這種模式在未來實體瘤MRD產品開發中可能成為主流。
腫瘤早篩巨頭Grail入局MRD領域的標志,便是與安進、阿斯利康以及百時美施貴寶達成戰略合作協議。這也進一步證實了,合作伙伴對于MRD玩家的重要性。
對絕大部分基因檢測玩家來說,雖然血液瘤的產品性能,不能平移到實體瘤,但依靠血液瘤建立的“朋友圈”的價值是巨大的。
誰能在當下得到更多藥企的信賴,意味著在實體瘤MRD檢測產品的開發,也能得到更多藥企的支持。
這將助力其實體瘤MRD檢測產品的開發,使得在整個MRD檢測領域的競爭中,更容易構建自身的護城河。
3月2日,魚躍醫療與中國足協中國之隊在北京隆重舉行"健康致敬體育精神"為主題的簽約發布會,正式宣布魚...
 2025-03-03
2025-03-03當 DeepSeek 以劃時代之姿,定義 AI 的全新高度,商業世界的未來走向,成為時代共同追問。
 2025-03-03
2025-03-03業績驅動因素方面,主要受益于消費類電子業務持續復蘇向好,新能源業務大幅增長,2024年公司營業收入創...
 2025-03-02
2025-03-02投資家網(www.51baobao.cn)是國內領先的資本與產業創新綜合服務平臺。為活躍于中國市場的VC/PE、上市公司、創業企業、地方政府等提供專業的第三方信息服務,包括行業媒體、智庫服務、會議服務及生態服務。長按右側二維碼添加"投資哥"可與小編深入交流,并可加入微信群參與官方活動,趕快行動吧。
